QUALITÀ
BIOLOGICA DEL SUOLO: ANALISI SVOLTE IN AREE DI IMPORTANZA TROFICA PER LA
POPOLAZIONE DI OCCHIONE NIDIFICANTE NEL PARCO REGIONALE DEL TARO
A cura di: dott. Paola
Peretti
MUSEO DI STORIA NATURALE
università DEGLI STUDI DI PARMA
INDICE
Parma, gennaio 2001 1
INDICE 1
PREMESSA 3
1. QUALITA’
BIOLOGICA DEL SUOLO (QBS) 3
1.1. INTRODUZIONE 3
1.2. PRELIEVO DEL CAMPIONE 4
1.3. ESTRAZIONE DEI MICROARTROPODI 4
1.4. ALLESTIMENTO DEI PREPARATI 4
1.5. DETERMINAZIONE DELLE FORME
BIOLOGICHE (FB) 4
1.6. CALCOLO DEL QBS 5
Tabella 1 -
Indici Ecomorfologici per il calcolo del QBS-ar 6
Note esplicative della tabella 1 6
Tabella 2 -
Completa per il calcolo degli EMI dei Collemboli 7
Tabella 3 -
Schema semplificato per il calcolo degli EMI dei Collemboli 9
Fig.1 –
All’interno dell’area evidenziata sono ubicate le aree di campionamento 11
Fig.2 – Foto
aerea n° 3024 20
Fig.3 – Foto
aerea n° 3050 28
Fig.4 – Foto
aerea n° 3051 35
2. MATERIALI
E METODI 40
2.1. CARATTERIZZAZIONE DELLE AREE DI CAMPIONAMENTO 41
Fig. 5 – Area D – Erba medica Fig. 6 – Area I – Mais incolto 51
Fig. 7 – Area F – Erba medica Fig. 8 – Area B – Bietole incolto 60
2.2. MODALITA’ DI CAMPIONAMENTO E ANALISI DEI CAMPIONI 65
2.3. TRAPPOLE A CADUTA PER LA RACCOLTA DI MACROFAUNA 74
Fig.9 – Campione di suolo al momento del prelievo 80
Fig.10 –
Selettore di Berlese-Tullgren in funzione 81
Fig. 11 –
Trappola caduta per la raccolta di macrofauna 88
Fig. 12 –
Prelievo del contenuto 95
3. RISULTATI
E DISCUSSIONE 98
3.1. Qualità Biologica del Suolo 99
Tabella 4 -
Dati relativi ai campioni di suolo prelevati nelle aree trofiche e nei
rispettivi controlli 107
Tabella 5 -
QBS-c e corrispondente QBS-ar. 165
3.2. Raccolta di macrofauna 185
Tab. 6 -
Gruppi sistematici rinvenuti con trappole a caduta (sono riportati gli
individui di dimensioni superiori a 1 cm). 192
Tab. 7 -
Gruppi sistematici rinvenuti con trappole a caduta (sono riportati gli
individui di dimensioni superiori a 1
cm). 226
Fig. 13 –
Differenze rilevate con trappole a caduta per la raccolta di macrofauna. 260
4. BIBLIOGRAFIA
CITATA E CONSULTATA 272
5. RINGRAZIAMENTI 326
6. APPENDICE 333
Il suolo, in quanto strato basale degli ecosistemi
terrestri, concorre a definirne la struttura ed il funzionamento; in rapporto a
ciò, risulta fondamentale poterne determinare la qualità biologica e poter
valutare il livello di biodiversità del popolamento edafico.
Nei sistemi naturali gli eventuali effetti di perturbazione
vanno studiati a livelli di organizzazione superiori, quali sono quelli di
popolazione e di comunità biologica; a tale scopo uno dei sistemi più
promettenti è rappresentato dai bioindicatori. I microentomati costituiscono
nel loro insieme una frazione rilevante dei microartropodi edafici e coprono
uno spettro ambientale e dimensionale completo del popolamento edafico. Alcuni
gruppi quali Collemboli e Proturi, che si sono evoluti nel suolo stesso e nelle
sue dipendenze più strette, costituiscono un insieme di forme primitivamente
edafiche, mentre altri, quali Ditteri e Coleotteri, si sono adattati alla vita
edafica con le sole larve o, in alcuni casi, anche con gli stessi adulti. Negli
organismi che vivono nel suolo è possibile evidenziare alcuni caratteri
morfologici indicativi di un adattamento specifico all'ambiente edafico; tali
caratteri possono essere più o meno evidenti in relazione per esempio al tempo che gli organismi
considerati trascorrono nel suolo: si distinguono organismi edafoxeni,
reperibili nel suolo solo occasionalmente, edafofili, che prediligono
l'ambiente edafico pur potendolo abbandonare ed edafobi, che compiono nel suolo l'intero ciclo vitale. I
microartropodi edafobi presentano quindi più sviluppati gli adattamenti convergenti,
quali riduzione delle dimensioni e miniaturizzazione, riduzione di antenne,
appendici ed eventuali organi deputati al salto, microatterismo o atterismo,
assottigliamento dei tegumenti, spesso testacei e privi di pigmentazione,
potenziamento delle strutture olfattive, dei chemiocettori ed igrocettori,
riduzione degli organi deputati alla vista fino alla anoftalmia e potenziamento
dell'organo postantennale nei collemboli. In base a questi caratteri è
possibile ripartire gli organismi in gruppi omogenei dal punto di vista
morfologico ed associare ad ogni gruppo un valore numerico, corrispondente ad
una qualificazione della dipendenza di tali organismi dal suolo e
dell'adattamento complessivo ad esso. La determinazione della Qualità Biologica
del Suolo (QBS) permette di superare le difficoltà che caratterizzano
un'analisi di tipo biocenotico, peraltro difficilmente realizzabile nel caso
della pedofauna, e fornisce informazioni relative al livello di biodiversità
della stazione in esame, attribuendo un peso maggiore alla presenza di forme
"confinate" e quindi più sensibili all'eventuale degrado
dell'ambiente in esame.
Il
presenta lavoro è stato realizzato con la finalità di valutare la Qualità
Biologica di aree di interesse trofico per la popolazione di Occhione (Burhinus oedicnemus (Linneo, 1758))
nidificante nel Parco Regionale del Taro.
La fauna del
suolo è costituita da organismi particolarmente sensibili ad alterazioni di origine naturale o antropica
ed agli equilibri chimico fisici che
caratterizzano questo ambiente, tali organismi sono quindi considerabili buoni
indicatori.
La procedura qui
descritta viene proposta per la valutazione della Qualità Biologica del Suolo
mediante un indice sintetico (QBS), descrittore sia delle caratteristiche del
popolamento di microartropodi del suolo, sia del livello di biodiversità della
stazione in esame. Tale indice si basa sull’applicazione del criterio delle forme biologiche (Sacchi, 1971) ai
microartropodi edafici, con il duplice intento di dare una valutazione del
livello di adattamento alla vita ipogea e di superare, sotto il profilo
operativo, le ben note difficoltà dell’analisi tassonomica a livello di specie.
Nei microartropodi del suolo il livello di adattamento alla vita edafica è
leggibile a livello dei caratteri somatici e, in particolare nei Collemboli,
questo può essere fatto senza spingere la
diagnosi fino al livello di specie. E’ evidente l’interesse applicativo
di poter procedere alla caratterizzazione del popolamento edafico di una
stazione, e quindi della stazione stessa, in maniera spedita, considerando che
esistono tecniche consolidate che permettono di effettuare in maniera
affidabile l’estrazione dei microartropodi presenti in un campione.
Le fasi
principali per determinare il QBS di una stazione sono le seguenti:
·
Prelievo del campione
·
Estrazione dei microartropodi
·
Allestimento dei preparati
·
Determinazione delle forme biologiche (FB)
·
Calcolo del QBS
Nella stazione in esame si individua un’area omogenea per
pendenza, esposizione e copertura vegetale (se presente) ove procedere al
prelievo di campioni; nel punto scelto è consigliabile, soprattutto in ambienti
naturali, definire il profilo pedologico e prelevare suolo in quantità tale da
poter eseguire anche analisi di tipo chimico-fisico. I campioni per la
determinazione del QBS vanno raccolti in periodi non secchi e non dopo piogge
abbondanti. Una volta individuata l’area si procede all’asportazione
dell’eventuale copertura erbacea (solo la porzione epigea) e della lettiera
(quest’ultima viene conservata a parte), si delimita una microarea di 10X10 cm
e si scava con un’apposita paletta fino ad una profondità di circa 10cm (5 in
suoli molto argillosi); il campione così raccolto (Fig. 9) viene riposto in un
apposito sacchetto, etichettato e riposto in un luogo non esposto al sole o
comunque non riscaldato. L’utilizzo di carotatori a sezione quadrata è limitato
a suoli privi di scheletro e di apparati radicali cospicui. Il campionamento,
da ripetersi periodicamente, implica ogni volta il prelievo di un solo campione
per area in esame in quanto, al fine della determinazione della Qualità Biologica
del Suolo, non sono determinanti né la densità né la distribuzione spaziale
della popolazione.
Una volta raccolto, il campione viene trasportato in
laboratorio avendo cura che non subisca forti sbalzi termici, e si procede,
entro le quarantotto ore dal prelievo, ad estrarre l’atmobios.
L’estrazione si effettua con il selettore di Berlese-Tullgren
(imbuto di 25 cm di diametro, setaccio con maglie di 2 mm, lampada da 60 Watt
posta a 25 cm di altezza sopra il setaccio) (Fig.10). Il campione viene posto
nel setaccio delicatamente, in uno strato omogeneo di circa 3 cm di altezza,
avendo cura che non resti scoperta alcuna porzione della superficie del
setaccio. Sotto l’imbuto viene posto un contenitore contenente un liquido
fissatore (due parti di alcool etilico ed una di glicerina). Il dispositivo di
estrazione va posto in un locale non disturbato e privo di sorgenti di
vibrazioni; si raccomanda, durante l’operazione di stratificazione del campione
nel setaccio, di porre sotto l’imbuto un contenitore senza liquido, il
terriccio che vi cadrà verrà riposto sopra al campione stratificato.
L’estrazione avrà una durata proporzionale al contenuto di acqua del campione
(si possono adottare dispositivi che consentono di determinare la perdita di
acqua dopo la selettura), in genere sono necessari almeno cinque giorni. Prima
di sospendere l’estrazione si consiglia di sostituire il contenitore contenente
il liquido fissatore con un secondo recipiente; il controllo di quest’ultimo,
dopo ventiquattr’ore, permette di stabilire se l’estrazione sia o meno
completa.
Posto termine all’estrazione si procede all’esame della
selettura; questo si effettua sugli esemplari conservati nello stesso liquido
di raccolta, utilizzando uno stereomicroscopio con ingrandimenti tra i 20X ed i
40X, versando il campione del contenitore di raccolta in una petri e ponendo
sotto di essa un reticolo che agevola l’esame stesso. Per i Collemboli può
essere utile una chiarificazione degli esemplari (ciò è necessario quando si
ritenga di dover procedere ad un approfondimento tassonomico), in questo caso
si consiglia l’utilizzo del liquido di Gisin (Gisin, 1960).
Si procede quindi a rilevare le diverse forme biologiche
presenti nella selettura: si ripartiscono gli esemplari presenti in gruppi il
più possibile omogenei dal punto di vista morfologico o Forme Biologiche (FB);
le FB sono quindi gruppi caratterizzati dall’avere gli stessi caratteri
morfologici convergenti. Questa ripartizione viene fatta in base ai caratteri
indicati nelle tabelle degli Indici Ecomorfologici (EMI), che permettono di
associare ad ogni gruppo un valore numerico (Tab. 1). Nel caso della tabella 1
si procede preliminarmente alla ripartizione degli esemplari per grandi gruppi,
come ivi indicato. La definizione dei gruppi omogenei è un’operazione molto
delicata, in quanto può portare a valutazioni scorrette del QBS: se si
attribuiscono FB diverse ad un unico gruppo si avrà una sottostima dell’indice,
se si ripartiscono arbitrariamente esemplari della stessa FB a FB differenti,
si avrà una sovrastima dell’indice. L’obiettivo della tabella 2 è appunto
quello di minimizzare tali possibili errori. Gli EMI servono non solo per la
valutazione del QBS della stazione, ma anche per verificare la congruenza tra
QBS e caratteristiche mesologiche della stazione stessa. Nel caso non sia abbia
una buona conoscenza delle diverse forme biologiche dei Collemboli, è possibile
utilizzare la tabella 3, di uso più rapido, attraverso la quale si determina un
valore EMI utilizzabile per il calcolo del QBS generale dei microartropodi. Si
dispone quindi di due indici: quello relativo a tutti i microartropodi (Tab.
1), che indicheremo con QBS-ar, che ci fornisce una visione più ampia e
complessiva del popolamento edafico, per il quale i valori degli EMI sono
compresi tra 1 e 20; quello relativo ai soli Collemboli, che indicheremo con
QBS-c, più specifico ma anche operativamente più difficile da determinare, per
il quale i valori degli EMI sono compresi tra 0 e 40 (Tab.2).
Una volta definiti gli EMI per i
diversi gruppi si può procedere al calcolo del QBS, il quale è semplicemente la
sommatoria dei differenti EMI. Vi è tuttavia una differenza tra il calcolo del
QBS-ar e quello del QBS-c: quando si determina il QBS-ar, ai gruppi aventi
caratteri morfologici di spiccato adattamento al suolo (ad esempio Proturi o
Acari), è assegnato un singolo valore di EMI, mentre per i gruppi nei quali è
possibile riconoscere differenti livelli di adattamento (ad esempio Collemboli
o Coleotteri), è indicato un intervallo di valori (valori maggiori vengono
assegnati alle specie maggiormente adattate alla vita nel suolo, l’attribuzione
del valore di EMI viene fatta in base alle note esplicative della tabella 1).
Se in un gruppo sono presenti più FB si adotta il valore più alto,
corrispondente al massimo adattamento mostrato dal gruppo in quella stazione.
Nel caso invece della determinazione del QBS-c, il valore dell’indice
corrisponde alla sommatoria di tutti gli EMI rilevati in base alla tabella 2,
nel caso si utilizzi tale valore per il calcolo del QBS-ar è necessario
dividelo per due; nel caso invece si utilizzi la tavola riportata in tabella
tre, il punteggio EMI scelto è direttamente utilizzabile per il calcolo del
QBS-ar. Tale differenza è da attribuirsi al fatto che, nel caso del QBS-ar, la
differenziazione tra le FB nell’ambito dei diversi gruppi non è omogenea (per
alcuni gruppi si assume un’unica FB, per altri se ne adottano diverse).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Gruppo
|
|
|
Punteggio
|
|
|
|
|
|
Proturi
|
|
|
20
|
|
|
|
|
|
Dipluri
|
|
|
20
|
|
|
|
|
|
Collemboli
|
|
1-20
|
|
|
|
|
|
Microcoryphia
|
|
10
|
|
|
|
|
|
Zygentomata
|
|
10
|
|
|
|
|
|
Dermatteri
|
|
1
|
|
|
|
|
|
Ortotteri
|
|
|
1-20
|
|
|
|
|
|
Embiotteri
|
|
10
|
|
|
|
|
|
Blattari
|
|
|
5
|
|
|
|
|
|
Psocotteri
|
|
1
|
|
|
|
|
|
Emitteri
|
|
|
1-10
|
|
|
|
|
|
Tisanotteri
|
|
1
|
|
|
|
|
|
Coleotteri
|
|
1-20
|
|
|
|
|
|
Imenotteri
|
|
1-5
|
|
|
|
|
|
Ditteri (larve)
|
|
10
|
|
|
|
|
|
Altri olometaboli (larve)
|
10
|
|
|
|
|
|
(adulti)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Per altri microartropodi viene proposto il seguente
punteggio:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Pseudoscorpioni
|
|
20
|
|
|
|
|
|
Palpigradi
|
|
20
|
|
|
|
|
|
Opilionidi
|
|
|
10
|
|
|
|
|
|
Araneidi
|
|
|
1-5
|
|
|
|
|
|
Acari
|
|
|
20
|
|
|
|
|
|
Isopodi
|
|
|
10
|
|
|
|
|
|
Diplopodi
|
|
10-20
|
|
|
|
|
|
Pauropodi
|
|
20
|
|
|
|
|
|
Sinfili
|
|
|
20
|
|
|
|
|
|
Chilopodi
|
|
|
10-20
|
|
|
Per alcuni gruppi sistematici è indicato un solo valore di
EMI, in altri casi un intervallo. Nel primo caso si tratta di un valore
massimale ritenuto rappresentativo del livello di adattamento al suolo del
gruppo stesso, nel secondo caso non si è ritenuto corretto attribuire un unico
valore di EMI, data la variabilità di caratteri presenti all’interno del
gruppo. Fatta eccezione per i Collemboli, per i quali è stato elaborato un
apposito sistema di determinazione del valore di EMI (che andrà diviso per due,
n quanto il valore massimo possibile è 40 e non 20 come nel sistema generale),
per gli altri gruppi si applica il seguente sistema.
Ortotteri In
generale il valore EMI è pari a 1, salvo il genere Grillotalpa (di agevole
riconoscimento). Si osserva tuttavia che si tratta più propriamente di
megafauna o macrofauna e pertanto non andrebbero conteggiati, come del resto i
membri della famiglia Grillidae. Per essi l’EMI è uguale a 20.
Emitteri In
generale perché forme per la maggior parte epigee o radicicole punti 1
Larve delle cicale, per le quali vale la
precedente osservazione punti
10
Coleotteri Per
le forme chiaramente epigee punti 1
I principali adattamenti alla vita endogena
rilevabili
nell’ispezione diretta degli esemplari
sono:
a) dimensioni
inferiori ai 2 mm punti 4
b) tegumenti
sottili, con colori, spesso testacei punti 5
c) microatterismo
o attesismo (relativamente alle ali
metatoraciche, carattere rilevabile per trasparenza) punti 5
d) microoftalmia
o anoftalmia punti 5
Imenotteri In generale punti 1
Formicidi punti 5
Araneidi Forme
piccole e scarsamente pigmentate punti 5
Forme
superiori ai 5 mm punti 1
Diplopodi Forme
superiori ai 5 mm punti 5
Forme
inferiori ai 5 mm punti
20
Chilopodi Forme
superiori ai 5 mm, ma con zampe ben sviluppate punti
10
Altre
forme punti
20
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Carattere
|
|
|
|
|
Punteggio
|
|
|
|
|
|
|
|
|
EMI
|
|
|
|
|
|
|
|
|
|
|
Dimensioni
|
|
|
|
|
|
|
|
-
|
grandi
|
> 3 mm
|
|
|
|
|
0
|
|
-
|
medie
|
2 - 3 mm
|
|
|
|
|
2
|
|
-
|
piccole
|
< 2 mm
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
Pigmentazione
|
|
|
|
|
|
|
|
-
|
con livrea complessa (es. Orchesella, Seira)
|
|
0
|
|
-
|
con livrea semplice (es. Isotomurus, Tomocerus)
|
|
1
|
|
-
|
concolore (o limitata alle appendici, distalmente)
|
|
3
|
|
-
|
assente
|
|
|
|
|
|
6
|
|
|
|
|
|
|
|
|
|
|
Fanere ed altre strutture tegumentarie
|
|
|
|
|
|
-
|
grande sviluppo di macrochete e/o squame, presenza
|
|
|
|
di tricobotri
|
|
|
|
|
0
|
|
-
|
ricoprimento modesto di fanere
|
|
|
1
|
|
-
|
specializzazione topografica delle chete, ridotte di
numero,
|
|
|
|
sensilli particolari sulle antenne, PAO presente, AD
|
|
|
|
|
presenti (questi caratteri possono non essere tutti
presenti)
|
3
|
|
-
|
poche chete, sensori e strutture particolari presenti in
|
|
|
|
più parti del corpo
|
|
|
|
|
6
|
|
|
|
|
|
|
|
|
|
|
Anoftalmia
|
|
|
|
|
|
|
|
-
|
8 + 8 ocelli
|
|
|
|
|
0
|
|
-
|
6 + 6 ocelli
|
|
|
|
|
2
|
|
-
|
da 5 + 5 a 1 + 1
|
|
|
|
|
3
|
|
-
|
0 + 0
|
|
|
|
|
|
6
|
|
|
|
|
|
|
|
|
|
|
Antenne
|
|
|
|
|
|
|
|
|
-
|
antenne molto più lunghe della diagonale del capo
|
|
0
|
|
-
|
circa equidimensionali
|
|
|
|
2
|
|
-
|
più corte
|
|
|
|
|
|
3
|
|
-
|
molto ridotte (spesso con sensilli particolari)
|
|
6
|
|
|
|
|
|
|
|
|
|
|
Zampe
|
|
|
|
|
|
|
|
|
-
|
molto sviluppate
|
|
|
|
|
0
|
|
-
|
mediamente sviluppate
|
|
|
|
2
|
|
-
|
corte
|
|
|
|
|
|
3
|
|
-
|
ridotte o con empodio ridotto o assente, unghia
|
|
|
|
|
spesso senza denticolazioni
|
|
|
|
6
|
|
|
|
|
|
|
|
|
|
|
Furca
|
|
|
|
|
|
|
|
|
-
|
molto sviluppata
|
|
|
|
|
0
|
|
-
|
mediamente sviluppata
|
|
|
|
2
|
|
-
|
poco sviluppata con riduzione del numero di setole
|
|
3
|
|
-
|
assenza di mucrone e/o alterazione della forma del
|
|
|
|
|
manubrio e dei denti
|
|
|
|
|
5
|
|
-
|
assenza della furca o sua riduzione a rudimento
|
|
6
|
|
|
|
|
|
|
|
|
|
|
Si osserva che l'EMI calcolato con questa tabella ha come
valore massimo 40 pertanto
|
|
può essere utilizzato per il calcolo del QBS-ar solo dopo
averlo diviso per due.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Carattere
|
|
|
|
|
|
|
Punteggio
|
|
|
|
|
|
|
|
|
|
EMI
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1)
|
Forme francamente epigee: appendici
allungate, ben sviluppate,
|
|
|
|
apparato visivo (macchia ocellare e
occhi) ben sviluppato, dimensioni
|
1
|
|
|
medie o grandi, presenza di livrea
complessa
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2)
|
Forme epigee non legate alla vegetazione
arborea, arbustiva o erbacea
|
|
|
|
con buon sviluppo dele appendici, con
forte sviluppo (eventualmente)
|
2
|
|
|
di setole o copertura fortemente
protettiva di squame, apparato
|
|
|
|
visivo ben sviluppato
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3)
|
Forme di piccola dimensione (ma non
necessariamente) con medio
|
|
|
|
sviluppo delle appendici, apparato
visivo sviluppato, livrea modesta,
|
4
|
|
|
forme generalmente limitate alla
lettiera
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4)
|
Forme emiedafiche con apparato visivo in
genere sviluppato, appendici
|
|
|
non allungate, livrea concolore
|
|
|
|
|
6
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5)
|
Forme emiedafiche con riduzione del
numero di ocelli, appendici poco
|
|
|
|
sviluppate, talvolta con furca ridotta o
assente, presenza di pigmentazione
|
8
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6)
|
Forme euedafiche con pigmentazione
assente, riduzione o assenza di
|
|
|
|
ocelli, furca presente ma ridotta
|
|
|
|
10
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7)
|
Forme francamente euedafiche:
depigmentate, prive di furca, appendici
|
|
|
tozze, presenza di struttura tipiche
come pseudooculi, PAO sviluppato
|
20
|
|
|
(carattere non necessariamente
presente), strutture sensoriali apomorfiche
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Il punteggio EMI determinato in base
alla presente tabella può essere direttamente utilizzato
|
|
per il calcolo del QBS-ar.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
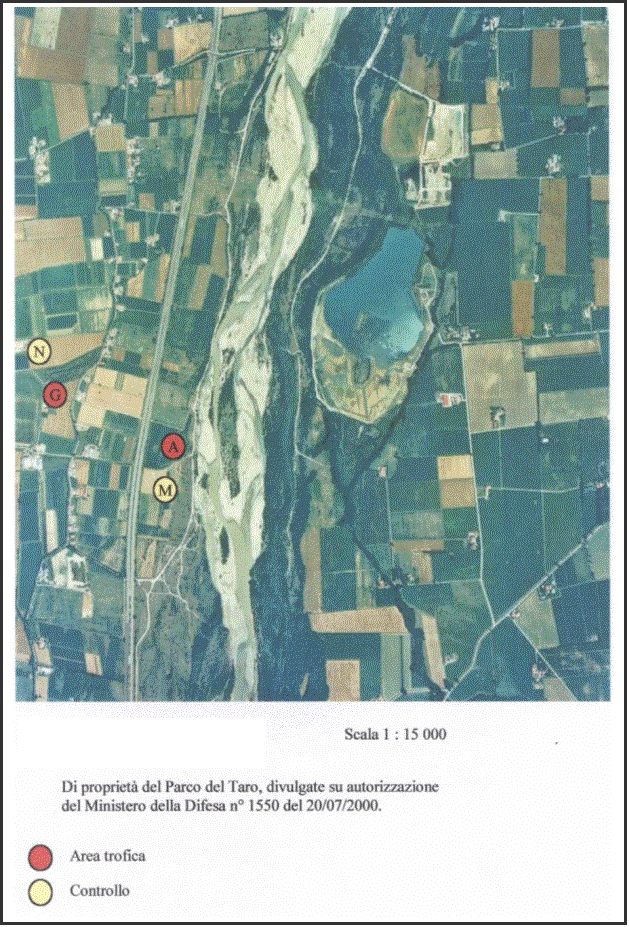
Le
aree di indagine sono state individuate attraverso indicazioni fornitemi dai
ricercatori responsabili del monitoraggio della popolazione di Occhione. Questa
specie infatti si riproduce nel greto del fiume Taro ed utilizza aree
perifluviali per il foraggiamento. Sono stati prelevati ed analizzati campioni
di suolo provenienti da ciascuna delle otto aree scelte dagli uccelli come siti
di foraggiamento ed individuate mediante radio-tracking; per ciascuna di esse è
stata scelta come controllo un’area limitrofa che non risultava essere di
interesse trofico per gli Occhioni. Essendo E ed F caratterizzati da colture
diverse ma tra loro confinanti, è stato scelto per entrambi un unico controllo
L (Fig. 4).
Ogni
area è contraddistinta da una lettera ed ogni campionamento in essa effettuato
da un numero romano (ad esempio: A II
corrisponde al secondo campionamento dell’area A).
Le aree contrassegnate dalle lettere A, B, C, D,
E, F, G, indicate nelle foto aeree con il colore rosso, indicano zone di foraggiamento,
dove sono stati effettuati tre campionamenti successivi, le aree H, I, L, M, N,
O, P, Q, indicate con il colore giallo, corrispondono alle aree di controllo,
studiate ciascuna con due campionamenti successivi (Fig. 2, 3, 4).
Le 15 aree sono localizzate dalla parte sinistra
rispetto al fiume Taro (Fig.1) e solo A ed il corrispondente controllo M si
trovano all’interno del territorio delimitato ad est dal fiume e ad ovest
dall’autostrada A15, mentre le rimanenti sono localizzate ad ovest rispetto all’autostrada.
A, E, F, G, L, M, N, sono ubicate nel comune di Noceto, H, I, D, B, C, O, P, Q,
nel comune di Medesano.
I terreni analizzati erano tutti adibiti ad uso
agricolo: le aree M, E ed R sono rimaste prato stabile durante l’intero periodo
di campionamento mentre A è stata mantenuta a prato fino all’inizio
dell’autunno, dopo il quale è stata seminata a frumento; l’area B è stata
coltivata a bietole durante il periodo estivo ed è successivamente rimasta
incolta; P, D, F, N, ed O erano coltivazioni di erba medica, mentre C, Q, I, G,
ed H, coltivate a mais in primavera, sono rimaste incolte durante tutto il
periodo estivo, al termine del quale solo H è stata arata.


(ottobre 2000) (ottobre 2000)


Area
E – Prato stabile (ottobre 2000)
(ottobre 2000)
All’interno dell’area prescelta veniva individuata una
zona omogenea come pendenza, esposizione e copertura vegetazionale, si asporta
la porzione epigea dell’eventuale copertura erbacea e della lettiera (se
presente) e si procedeva al prelievo di una “mattonella” di suolo avente
dimensioni di 10x10 cm e profonda circa 10-15 cm (Fig. 9). Per il campionamento
non è stato utilizzato un carotatore in quanto l'uso di questo strumento è
limitato a suoli privi di scheletro e di apparati radicali cospicui, inoltre le
percussioni necessarie per inserirlo nel terreno influiscono negativamente
sulle condizioni della fauna edafica. Ogni campionamento prevedeva il prelievo
di un solo campione per ogni area in esame.
I campioni non potevano essere raccolti in ogni periodo
dell’anno, ma solo quando è massima la biodiversità, quindi non durante i
periodi estremamente caldi oppure dopo piogge abbondanti o forte vento. La
prima serie analizzata è stata prelevata a partire dal 17/05/2000, subito dopo
l’individuazione delle aree di interesse trofico per gli Occhioni, mentre
durante la seconda metà del mese di giugno l’elevata temperatura ha reso
impossibile proseguire. Il campionamento è ripreso il 09/10/2000 ed è stato in
parte ostacolato dall’elevata piovosità
dei mesi autunnali.
Durante la raccolta dei campioni sono state rilevate la
temperatura del terreno e quella dall’aria (misurate in °C), registrate l’ora
del prelievo e le condizioni meteorologiche locali. I campioni raccolti
venivano portati in laboratorio avendo cura di evitare sbalzi termici, a cui la
fauna edafica è particolarmente sensibile, e qui sono stati calcolati per
ognuno l’acqua in esso contenuta e l’acqua di ritenzione. Per il campione PI
non è stato possibile calcolare l’acqua in esso contenuta per difficoltà
tecniche.
I campioni di suolo venivano poi sistemati nel selettore
di Berlese -Tullgren (Fig. 10), dove rimanevano per un periodo di circa 12
giorni. Questo metodo di estrazione della mesofauna e della macrofauna di
minori dimensioni sfrutta i tropismi degli organismi edafici, essi infatti
tendono a sfuggire sia l’innalzamento termico sia la continua riduzione della
disponibilità di acqua contenuta nel campione, dovute alla costante
evaporazione causata dalla lampada. Gli individui estratti cadevano nel
recipiente contenente il liquido fissatore (alcol e glicerina in proporzioni di
3:1). Dopo circa una settimana il recipiente di raccolta veniva sostituito, al
fine di verificare se l’estrazione avvenuta durante la prima settimana fosse
stata completata.
Per migliore conferma del metodo da ciascuna delle aree
A, B, D ed E, in data 19/06/2000, sono stati raccolti contemporaneamente due
campioni di suolo, uno dei quali è stato posto in un selettore con lampadina da
60 w mantenuta costantemente accesa,
mentre l’altro in un selettore equivalente la cui lampada è rimasta spenta.
Questo con lo scopo di verificare se la costante evaporazione e la continua
riduzione della disponibilità di acqua indotte dal calore della lampada
potessero favorire l’estrazione della fauna edafica. I campioni ottenuti per
selettura senza lampada sono indicati con un asterisco: A II*, B II*, D II*, E
II*.
In ciascuno dei campioni ottenuti per selettura si è
proceduto alla determinazione dei gruppi presenti. Nel caso dei microartropodi
è stato fatto un riconoscimento a livello di ordine e ad ogni gruppo sono stati
associati i corrispondenti valori numerici degli EMI, la cui sommatoria ci
fornisce il QBS-ar.
Per un ulteriore approfondimento dello studio del
popolamento edafico sono stati individuati quattro campioni aventi colture
diverse (mais, bietole, erba medica e prato stabile) e per ciascuno di questi è
stato calcolato il QBS-c.
A completamento del quadro faunistico, all’interno
dell’area A e del corrispondente controllo I sono state posizionate due serie di
10 di trappole a caduta per ciascuna area, per un totale di 40 trappole. Queste
consistevano in recipienti di plastica del diametro di 7cm e profonde 9,5cm,
parzialmente riempite con Glicole etilenico monoetiletere, interrate a livello
del suolo e coperti con una pietra mantenuta leggermente sollevata ad una delle
estremità (Fig. 11). In entrambe le aree sono state interrate in due fasi
successive 10 trappole, disposte in due file parallele, ad una distanza di
circa quattro metri l’una dall’altra. 20 trappole (rispettivamente 10
nell’area A e 10 nell’area I), sono state posizionate in data 01/10/2000 e
mantenute in loco fino al 12/10/2000; altre 20, disposte in modo equivalente,
sono state posizionate in data10/11/2000 rimosse il 06/12/2000. L’elevata piovosità
che ha caratterizzato il mese di novembre ha in parte ostacolato la raccolta di
macrofauna ed è per questo motivo che la seconda serie di trappole è stata
lasciata in loco per in periodo di tempo più lungo.
Ogni due giorni venivano
controllate le singole trappole e
prelevato il contenuto (Fig.12). Al fine di comparare i dati relativi
alle trappole dell’area D con quelli del corrispondente controllo, sono state
calcolate le sommatorie, in valore assoluto, delle differenze dei totali degli
individui appartenenti a ciascuno dei gruppi sistematici rinvenuti durante
l’intero periodo di campionamento (Fig.13)

Come
esposto nell’introduzione lo scopo di questa indagine è stato quello di caratterizzare
sotto il profilo edafologico gli ambienti utilizzati a scopo trofico
dall’Occhione. Le tecniche adottate (analisi dei microartropodi edafici per la
valutazione del QBSI e trappolaggio della macrofauna) si sono dimostrate
affidabili, permettendo di arrivare ad alcune considerazioni conclusive. In
tabella 4 vengono riportati i dati relativi ai campionamenti effettuati nel
corso dell’intero periodo di studio. I dati dei singoli campioni sono riportati
in appendice. Osservando i dati raccolti emerge come i campioni di prato
stabile siano quelli con valori di QBS-ar mediamente più alti (valore medio
117,44), raggiungendo con 196 il valore
più alto; in tali campioni sono stati rinvenuti microartropodi particolari,
quali Folsomides parvulus, collembolo
caratteristico di suoli periodicamente esondabili, esemplari di dipluro
Japygidae e di proturi, ordini caratteristici di suoli stabili e maturi. I
suddetti suoli presentano anche i valori maggiori di acqua di ritenzione, ad
eccezione dei campioni E II ed E II*, prelevati sull’argine ai bordi del prato
stabile, in una zona con particolari caratteristiche granulometriche, dove il
suolo è, con buona probabilità, sabbioso ed incoerente. I campioni prelevati in
colture di erba medica presentano valori di QBS-ar mediamente inferiori a
quelli del prato stabile (valore medio 90,75), raggiungendo il valore massimo
di 141; anche nel campione O I è stato rinvenuto un esemplare di dipluro
Japygidae, ed è interessante sottolineare la presenza nel campione D I di
pseudoscorpioni, caratteristici di suoli maturi. L’acqua di ritenzione presenta
valori comparabili a quelli dei campioni di prato stabile ad eccezione del
campione O II. I campioni provenienti da campi di mais hanno valori di QBS-ar
mediamente inferiori (valore medio77,08) a quelli calcolati per i campioni di
erba medica, anche se sono emersi casi in cui i valori raggiunti sono
comparabili a quest’ultimi (il campione Q II raggiunge valore 100). Infine i
suoli provenienti da campi coltivati a bietola presentano i valori di QBS-ar
più bassi (valore medio 59,5). L’acqua di ritenzione dei campioni di mais e
bietola presenta valori comparabili a quelli del prato stabile.
Per
quanto riguarda i valori relativi all’acqua contenuta nei campioni è emerso un
effetto stagionale, riscontrabile nella minor percentuale che caratterizza i
campioni prelevati nel mese di giugno, fattore che dovrà essere tenuto in
considerazione nella programmazione di eventuali campionamenti successivi.
Confrontando
tra loro i valori medi dei QBS-ar calcolati per le quattro diverse colture che
caratterizzano le aree esaminate, emerge come i valori maggiori caratterizzano
i prati stabili, di poco inferiori sono quelli relativi ai campi di erba
medica; i valori calcolati per le colture di mais sono inferiori a quelli delle
colture di erba medica, mentre i valori più bassi caratterizzano le colture di
bietola. Il metodo utilizzato è stato applicato in ricerche condotte in 8
diverse aree padane, localizzate rispettivamente in pianura, in bassa collina
ed in alta collina (sopra i 1000 m), dove sono stati analizzati sia ecosistemi
prativi e forestali spontanei (non sottoposti ad interventi umani), sia colture
tra loro differenti quali mais, bietole, frumento e terreni adibiti a pioppeto
(Gardi & Parisi, 2000; Ampollini, 2000; D’Avino, 2000; Scalvenzi, 2000,
Visentini, 1999). Mediante l’applicazione dell’indice è stato possibile
verificare come i suoli delle coltivazioni di mais e bietole hanno valori di
QBS-ar bassi (< 50), mentre gli ecosistemi forestali sono quelli che
presentano valori più alti (anche > 200). Possiamo affermare che i valori di
Qualità Biologica del Suolo determinati nelle aree esaminate sono da
considerarsi elevati rispetto a quelli di suoli analizzati in altre aree aventi
lo stesso tipo di coltura, questo è con buona probabilità da attribuirsi al
fatto che non si tratta di colture intensive, dove l’intervento umano è
frequente e spesso devastante dal punto di vista biologico.
Per
quanto riguarda il confronto tra le aree di interesse trofico per l’Occhione ed
i rispettivi controlli, in 5 casi su 8 i valori di QBS-ar delle aree trofiche
sono risultati inferiori a quelli dei rispettivi controlli; non è quindi emersa
nessuna differenza significativa nei valori di QBS-ar tra le aree trofiche ed i
rispettivi controlli. Possiamo comunque affermare che le aree di importanza
trofica per l’Occhione sono tutte caratterizzate da valori elevati di QBS-ar.
I
risultati relativi all’indice QBS-c confermano le differenze rilevate tra le
diverse colture con l’indice QBS-ar (correlazione di 0,891) (Tab. 5). I dati
relativi ai singolo campioni sono riportati in appendice.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Campione
|
Coltura
|
Data
|
Ora
|
T° al suolo (in °C )
|
T° aria (in °C )
|
Acqua contenuta nel
campione
|
Acqua di ritenzione
|
QBS-ar
|
|
A
|
I
|
prato
stabile
|
17/05/2000
|
9,30
|
23
|
20,5
|
13,06%
|
40,09%
|
147
|
|
|
II - II*
|
prato
stabile
|
19/06/2000
|
15,00
|
33
|
31
|
6,52%
|
50,59%
|
77
- 57*
|
|
|
III
|
seminato
frumento
|
13/12/2000
|
13,20
|
10
|
11
|
18,32%
|
38,65%
|
65
|
|
M
|
I
|
prato stabile
|
28/11/2000
|
11,30
|
9
|
11
|
17,79%
|
45,71%
|
132
|
|
|
II
|
prato stabile
|
13/12/2000
|
13,15
|
10
|
10
|
22,91%
|
44,69%
|
97
|
|
|
|
|
|
|
|
|
|
|
|
|
B
|
I
|
bietole
|
17/05/2000
|
11,00
|
24,5
|
27
|
12,50%
|
36,74%
|
67
|
|
|
II
- II*
|
bietole
|
19/06/2000
|
15,30
|
26
|
28
|
7,38%
|
41,66%
|
52
- 42*
|
|
|
III
|
incolto
|
09/10/2000
|
10,40
|
14,5
|
17
|
16,41%
|
43,91%
|
51
|
|
P
|
I
|
erba medica
|
24/11/2000
|
10,40
|
9,5
|
8,5
|
nc
|
44,37%
|
48
|
|
|
II
|
erba medica
|
12/12/2000
|
11,15
|
10
|
7
|
23,33%
|
49,43%
|
77
|
|
|
|
|
|
|
|
|
|
|
|
|
C
|
I
|
mais
|
17/05/2000
|
11,15
|
19,5
|
25
|
12,73%
|
35,06%
|
73
|
|
|
II
|
mais
raccolto
|
09/10/2000
|
10,50
|
15
|
15,5
|
18,11%
|
39,12%
|
85
|
|
|
III
|
mais
raccolto
|
24/11/2000
|
10,15
|
9,5
|
8,5
|
19,81%
|
40,05%
|
80
|
|
Q
|
I
|
mais raccolto
|
24/11/2000
|
10,15
|
9,5
|
8,5
|
15,65%
|
44,22%
|
60
|
|
|
II
|
mais raccolto
|
12/12/2000
|
11,20
|
9
|
7
|
23,15%
|
47,75%
|
100
|
|
|
|
|
|
|
|
|
|
|
|
|
D
|
I
|
erba
medica
|
17/05/2000
|
11,30
|
21,8
|
28
|
12,68%
|
40,83%
|
78
|
|
|
II - II*
|
erba
medica
|
19/06/2000
|
15,20
|
26
|
27
|
10,76%
|
44,15%
|
59
- 53*
|
|
|
III
|
erba
medica
|
09/10/2000
|
12,00
|
15,7
|
17
|
17,08%
|
47,70%
|
79
|
|
I
|
I
|
mais incolto
|
09/10/2000
|
11,10
|
16
|
18
|
17,31%
|
42,76%
|
92
|
|
|
II
|
mais incolto
|
24/11/2000
|
11,30
|
10
|
8,8
|
15,26%
|
42,33%
|
78
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Campione
|
Coltura
|
Data
|
Ora
|
T° al suolo (in °C )
|
T° aria (in °C )
|
Acqua contenuta nel
campione
|
Acqua di ritenzione
|
QBS-ar
|
|
E
|
I
|
prato
stabile
|
02/06/2000
|
9,30
|
22
|
23
|
16,37%
|
60,36%
|
101
|
|
|
II - II*
|
prato
stabile
|
19/06/2000
|
15,50
|
27
|
29
|
6,83%
|
8,63%
|
196
- 162*
|
|
|
III
|
prato
stabile
|
09/10/2000
|
9,45
|
16,5
|
15
|
25,58%
|
72,07%
|
99
|
|
L
|
I
|
prato stabile
|
09/10/2000
|
10,10
|
16,5
|
15
|
21,34%
|
59,34%
|
91
|
|
|
II
|
prato stabile
|
24/11/2000
|
9,30
|
10
|
9
|
17,06%
|
44,85%
|
117
|
|
|
|
|
|
|
|
|
|
|
|
|
F
|
I
|
erba
medica
|
02/06/2000
|
9,40
|
23
|
23
|
14,87%
|
45,08%
|
112
|
|
|
II
|
erba
medica
|
09/10/2000
|
9,55
|
17
|
15
|
19,64%
|
53,93%
|
141
|
|
|
III
|
erba
medica
|
24/11/2000
|
12,20
|
10
|
7,5
|
15,22%
|
47,65%
|
128
|
|
L
|
I
|
prato stabile
|
09/10/2000
|
10,10
|
16,5
|
15
|
21,34%
|
59,34%
|
91
|
|
|
II
|
prato stabile
|
24/11/2000
|
9,30
|
10
|
9
|
17,06%
|
44,85%
|
117
|
|
|
|
|
|
|
|
|
|
|
|
|
G
|
I
|
mais
|
02/06/2000
|
10,05
|
30
|
26
|
16,60%
|
40,12%
|
46
|
|
|
II
|
mais
|
09/10/2000
|
12,30
|
16,5
|
19,5
|
21,76%
|
47,14%
|
98
|
|
|
III
|
mais
|
24/11/2000
|
11,45
|
10
|
8
|
24,51%
|
48,65%
|
65
|
|
N
|
I
|
erba medica
|
24/11/2000
|
12,05
|
9,5
|
7,8
|
19,45%
|
45,68%
|
93
|
|
|
II
|
erba medica
|
12/12/2000
|
10,40
|
10
|
7
|
23,67%
|
51,75%
|
134
|
|
|
|
|
|
|
|
|
|
|
|
|
H
|
I
|
mais
|
02/06/2000
|
10,30
|
24
|
24,5
|
13,26%
|
42,40%
|
61
|
|
|
II
|
mais incolto
|
28/11/2000
|
11,50
|
7
|
9
|
22,97%
|
49,28%
|
87
|
|
|
III
|
arato
|
23/12/2000
|
12,15
|
9
|
11
|
23,30%
|
47,24%
|
147
|
|
O
|
I
|
erba medica
|
28/11/2000
|
12,10
|
6
|
8
|
21,68%
|
42,76%
|
103
|
|
|
II
|
erba medica
|
13/12/2000
|
11,20
|
10
|
10
|
24,06%
|
33,21%
|
37
|
|
|
|
|
|
|
|
|
|
|
|
|
|
aree trofiche
|
|
controlli
|
|
|
|
|
|
|
|
* :
campioni ottenuti con selettore senza lampada
|
|
|
|
|
|
In tabella 6 ed in tabella 7 vengono riportati i gruppi sistematici
rinvenuti con le trappole a
caduta. I dati relativi alle singole trappole vengono riportati in
appendice.
Analizzando i dati raccolti emerge come, considerando l’area trofica D
durante il primo periodo di campionamento, il gruppo quantitativamente più
numeroso sia quello degli stafilinidi, gli opilionidi sono presenti con un
numero di individui di poco inferiore, mentre carabidi, isteridi, limacidi,
blattari, formicidi, ortotteri e larve di coleotteri sono presenti con valori
tra loro comparabili. Considerando l’area di controllo I durante lo stesso
periodo di campionamento emerge come il gruppo più numeroso siano i limacidi;
stafilinidi, carabidi, formicidi, ditteri e ortotteri sono presenti con un
numero inferiore di individui.
Considerando
i dati relativi al secondo periodo di campionamento emerge come nell’area D i
diplopodi siano presenti in numero decisamente superiore, limacidi e lombrichi
sono presenti con valori tra loro comparabili, numericamente inferiore rispetto
a questi ultimi è invece la presenza di larve di coleotteri. Nell’area I
prevalgono numericamente i ditteri, lombrichi, limacidi e larve di coleotteri
sono presenti con valori tra loro comparabili, larve di ditteri e carabidi con
valori inferiori. E’ interessante notare che all’interno delle trappole
disposte in quest’area sono stati rinvenuti due esemplari di Triturus carnifex
(Laurenti,1768). L’insieme dei dati mostra come, sia nelle aree trofiche sia in
quelle di controllo, sono presenti molti dei gruppi zoologici che rientrano
nella dieta dell’Occhione. Il fatto di non aver rilevato una sostanziale
differenza, per quanto concerne questo tipo di analisi, tra le aree esaminate,
nonostante la cospicuità dei dati, sembra indicare che il differente utilizzo
di queste aree da parte dell’Occhione vada ricercato in altri aspetti degli
ambienti considerati. Nonostante il carattere preliminare dei dati raccolti,
che andrebbero confermati da ricerche condotte per un più lungo periodo di
tempo data la complessità del mosaico ambientale, riteniamo di estrema
importanza, al fine della qualità biologica del suolo, le dimensioni
relativamente modeste dei campi coltivati, la pratica di colture differenti in
campi tra loro confinanti e la diffusa presenza di siepi, filari di viti ed
alberi ad alto fusto. Questo complesso mosaico ambientale, estremamente
articolato, favorisce con buona probabilità la ricolonizzazione del suolo da
parte dei microartropodi, quando questo viene impoverito dalle pratiche
agricole, ed indirettamente anche dei rappresentanti della macrofauna
importanti per il regime alimentare dell’Occhione.
Fig. 13 –
Differenze rilevate con trappole a caduta per la raccolta di macrofauna.
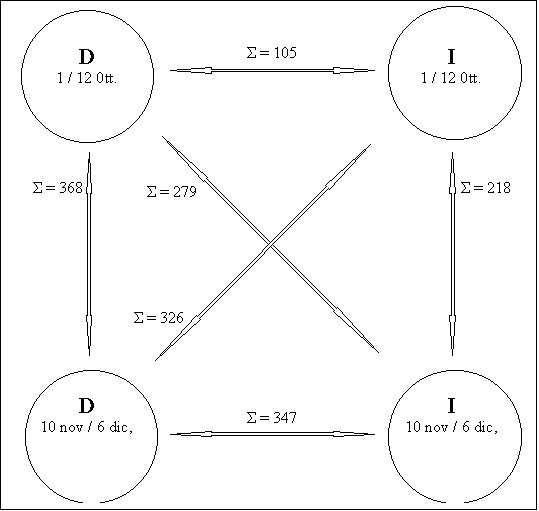
D : area
trofica
I : controllo
Σ : sommatoria in valore assoluto delle
differenze dei totali degli individui appartenenti a ciascuno dei gruppi
sistematici (Tab. 5, Tab. 6).
Le date si riferiscono ai periodi di
campionamento.
ALVAREZ T.,
GEOFF K., GOULSON F., GOULSON D., 2000, The role of hedgerows in the
recolonisation of arable fields by epigeal Collembola, Pedobiologia, 44, 516-525.
AMPOLLINI D., 2000, Contributo dei microartropodi
nella valutazione della qualità biologica del suolo, Tesi di laurea, Università degli studi di Parma.
D'AVINO L., 2000, Ipotesi di riconversione
ecocompatibile dell'agricoltura intensiva, Tesi
di laurea, Università degli studi di Parma.
BONAVITA P.,
CHEMINI C, 1996, Structures and indicator role of carabid assemblages from wet
areas of the province of Trento,
Italian Alps (Coleoptera, Carabidae), Quad. Staz. Ecol. civ. Mus. St. nat.
Ferrara, 10, 107-123.
COINEAU Y.,
CLEVA R., DU CHATENET G., 1997, Ces animaux minuscules qui nous entourent,
Delachaux et Niestlè, Paris.
GARDI C., PARISI V.,
in press, Confronto tra bioindicatori
e parametri chimico-fisici nella valutazione della qualità di suoli soggetti a
diverse forme d'uso. Convegno "Indicatori per la qualità del suolo:
prospettive ed applicabilità". Roma, 29/03/2000.
GREEN
R.E.,TYLER G.A., BOWDEN C.G.R.,2000, Habitat selection, ranging behaviour and diet of stone curlew (Burhinus
oedicnemus) in southern England, Journal
of zoology, 250 (2), 161-183.
GHISIN H, 1960,
Collembolenfauna Europas, Museum D' Histoire Naturelle, Genève.
MATTHEY W., DELLA SANTA E., WANNENMACHER C.,1992,
Guida pratica all'ecologia, Zanichelli, Bologna.
PROVINI A., GALASSI S.,MARCHETTI R., 1998, Ecologia applicata, CittàStudiEdizioni, Torino.
PARISI V., 1974, Biologia e ecologia del suolo,
Boringhieri, Torino.
RAVASINI M., 1995,
L'avifauna nidificante nella provincia di Parma, Editoria
Tipolitotecnica di Sala Baganza, Parma.
A.A. V.V., 1994, Il Parco Fluviale Regionale del
Taro, Regione Emilia - Romagna.
SACCHI C.F., TESTARD P., 1971, Ecologie
animale, Doin, Parigi.
SCALVENZI M., 2000,
Lo smaltimento dei rifiuti in discarica: il caso della discarica di
"Pian di Tiedoli" (media val Taro), Tesi di laurea, Università degli studi di Parma.
VISENTINI D., 1999,
Ricerche su ambienti ripariali del parco dello Stirone dopo interventi
di ingegneria naturalistica, Tesi di
laurea, Università degli studi di Parma.
Rivolgo al Prof. V. Parisi,
direttore del Museo di Storia Naturale, un ringraziamento particolare per la
guida che sempre sa essere.
Grazie anche alla
dott.ssa Menta, amica e collaboratrice in ogni momento disponibile. Non mi
sarebbe stato possibile svolgere questo lavoro senza la collaborazione della
Prof. Mezzadri, del dott. Bulla, di Franca,compagna di tante uscite, e di
Giorgia. Grazie anche alla dott.ssa Pollonara, al dott. Giunchi ed ai guardaparco
Zinelli e Carini, che più di una volta ho disturbato.
(Omissis….)